الکترونگاتیوی پاولینگ
الکترونگاتیوی پاولینگ
اولین بار پاولینگ در سال 1932، مفهوم الکترونگاتیوی عناصر را در شیمی وارد و آن را چنین توصیف کرد:
«الکترونگاتیوی هر عنصر عبارت از میزان تمایل اتم آن به جذب الکترونهای پیوندی به سمت خود، در یک مولکول است».
قابل توجه است که الکترونگاتیوی را معمولاً با علامت  نشان میدهند (
نشان میدهند ( یکی از حروف الفبای یونانی است که کای«
یکی از حروف الفبای یونانی است که کای«  » تلفظ میشود).
» تلفظ میشود).
 نشان میدهند (
نشان میدهند ( یکی از حروف الفبای یونانی است که کای«
یکی از حروف الفبای یونانی است که کای«  » تلفظ میشود).
» تلفظ میشود).در آن زمان معلوم شده بود که انرژی پیوند مولکول دو اتمی ناجور هسته 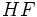 از میانگین انرژیهای پیوندی مولکولهای غیرقطبی جور هسته
از میانگین انرژیهای پیوندی مولکولهای غیرقطبی جور هسته  بیشتر است. در آنجا این افزایش قدرت پیوندی به قطبیت پیوند نسبت داده شد. از طرفی قطبیت پیوند ناشی از اختلاف الکترونگاتیوی دو اتم میباشد. لینوس پائولینگ شیمیدان برجسته و برنده دو جایزه نوبل شیمی و صلح بر مبنای همین ارتباط اولین مقیاس الکترونگاتیوی را در سال 1932 میلادی پیشنهاد کرد. این مقیاس را الکترونگاتیوی پائولینگ مینامند. در واقع اختلاف انرژی پیوندی تجربی و محاسبه شده با فرض بر این که مولکول کاملاً غیرقطبی باشد، معیاری برای اختلاف الکترونگاتیوی دو اتم میباشد. برای مثال، اگر بر روی اتمهای برم و هیدروژن در مولکول
بیشتر است. در آنجا این افزایش قدرت پیوندی به قطبیت پیوند نسبت داده شد. از طرفی قطبیت پیوند ناشی از اختلاف الکترونگاتیوی دو اتم میباشد. لینوس پائولینگ شیمیدان برجسته و برنده دو جایزه نوبل شیمی و صلح بر مبنای همین ارتباط اولین مقیاس الکترونگاتیوی را در سال 1932 میلادی پیشنهاد کرد. این مقیاس را الکترونگاتیوی پائولینگ مینامند. در واقع اختلاف انرژی پیوندی تجربی و محاسبه شده با فرض بر این که مولکول کاملاً غیرقطبی باشد، معیاری برای اختلاف الکترونگاتیوی دو اتم میباشد. برای مثال، اگر بر روی اتمهای برم و هیدروژن در مولکول 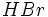 همانند مولکولهای
همانند مولکولهای  هیچگونه باری متمرکز نباشد. بدین معنی است که اختلافی بین الکترونگاتیوی دو اتم وجود ندارد. چون تغییرات انرژی در واکنشهای شیمیایی از تغییر انرژی الکترونها ناشی میشود، بنابراین انتظار میرود در طی این واکنش انرژی مصرف یا تولید نشود، یعنی انرژی پیوندی
هیچگونه باری متمرکز نباشد. بدین معنی است که اختلافی بین الکترونگاتیوی دو اتم وجود ندارد. چون تغییرات انرژی در واکنشهای شیمیایی از تغییر انرژی الکترونها ناشی میشود، بنابراین انتظار میرود در طی این واکنش انرژی مصرف یا تولید نشود، یعنی انرژی پیوندی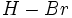 باید با میانگین انرژیهای پیوندی
باید با میانگین انرژیهای پیوندی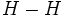 و
و 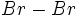 برابر باشد:
برابر باشد:
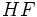 از میانگین انرژیهای پیوندی مولکولهای غیرقطبی جور هسته
از میانگین انرژیهای پیوندی مولکولهای غیرقطبی جور هسته  بیشتر است. در آنجا این افزایش قدرت پیوندی به قطبیت پیوند نسبت داده شد. از طرفی قطبیت پیوند ناشی از اختلاف الکترونگاتیوی دو اتم میباشد. لینوس پائولینگ شیمیدان برجسته و برنده دو جایزه نوبل شیمی و صلح بر مبنای همین ارتباط اولین مقیاس الکترونگاتیوی را در سال 1932 میلادی پیشنهاد کرد. این مقیاس را الکترونگاتیوی پائولینگ مینامند. در واقع اختلاف انرژی پیوندی تجربی و محاسبه شده با فرض بر این که مولکول کاملاً غیرقطبی باشد، معیاری برای اختلاف الکترونگاتیوی دو اتم میباشد. برای مثال، اگر بر روی اتمهای برم و هیدروژن در مولکول
بیشتر است. در آنجا این افزایش قدرت پیوندی به قطبیت پیوند نسبت داده شد. از طرفی قطبیت پیوند ناشی از اختلاف الکترونگاتیوی دو اتم میباشد. لینوس پائولینگ شیمیدان برجسته و برنده دو جایزه نوبل شیمی و صلح بر مبنای همین ارتباط اولین مقیاس الکترونگاتیوی را در سال 1932 میلادی پیشنهاد کرد. این مقیاس را الکترونگاتیوی پائولینگ مینامند. در واقع اختلاف انرژی پیوندی تجربی و محاسبه شده با فرض بر این که مولکول کاملاً غیرقطبی باشد، معیاری برای اختلاف الکترونگاتیوی دو اتم میباشد. برای مثال، اگر بر روی اتمهای برم و هیدروژن در مولکول 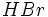 همانند مولکولهای
همانند مولکولهای  هیچگونه باری متمرکز نباشد. بدین معنی است که اختلافی بین الکترونگاتیوی دو اتم وجود ندارد. چون تغییرات انرژی در واکنشهای شیمیایی از تغییر انرژی الکترونها ناشی میشود، بنابراین انتظار میرود در طی این واکنش انرژی مصرف یا تولید نشود، یعنی انرژی پیوندی
هیچگونه باری متمرکز نباشد. بدین معنی است که اختلافی بین الکترونگاتیوی دو اتم وجود ندارد. چون تغییرات انرژی در واکنشهای شیمیایی از تغییر انرژی الکترونها ناشی میشود، بنابراین انتظار میرود در طی این واکنش انرژی مصرف یا تولید نشود، یعنی انرژی پیوندی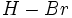 باید با میانگین انرژیهای پیوندی
باید با میانگین انرژیهای پیوندی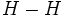 و
و 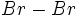 برابر باشد:
برابر باشد: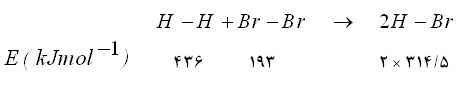
به طور کلی انرژی پیوندی محاسبه شده بین دو اتم 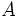 و
و 
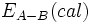 میانگین از انرژیهای پیوندی
میانگین از انرژیهای پیوندی 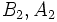 است و نتیجه میگیریم که:
است و نتیجه میگیریم که:
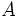 و
و 
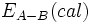 میانگین از انرژیهای پیوندی
میانگین از انرژیهای پیوندی 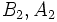 است و نتیجه میگیریم که:
است و نتیجه میگیریم که: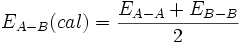
ولی همچنانکه از جدول انرژی پیداست انرژی پیوند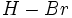 ،
،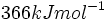 است. عدم تطابق بین مقادیر تجربی و محاسبه شده دلالت بر نادرست بودن فرض یکسان بودن الکترونگاتیوی دو اتم دارد. بنابراین اختلاف انرژیهای پیوندی تجربی
است. عدم تطابق بین مقادیر تجربی و محاسبه شده دلالت بر نادرست بودن فرض یکسان بودن الکترونگاتیوی دو اتم دارد. بنابراین اختلاف انرژیهای پیوندی تجربی  و محاسبه شده
و محاسبه شده  که انرژی رزونانس یونی نامیده میشود را میتوان معیاری از اختلاف الکترونگاتیوی دو اتم
که انرژی رزونانس یونی نامیده میشود را میتوان معیاری از اختلاف الکترونگاتیوی دو اتم 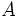 و
و  در نظر گرفت (معادله زیر):
در نظر گرفت (معادله زیر):
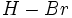 ،
،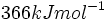 است. عدم تطابق بین مقادیر تجربی و محاسبه شده دلالت بر نادرست بودن فرض یکسان بودن الکترونگاتیوی دو اتم دارد. بنابراین اختلاف انرژیهای پیوندی تجربی
است. عدم تطابق بین مقادیر تجربی و محاسبه شده دلالت بر نادرست بودن فرض یکسان بودن الکترونگاتیوی دو اتم دارد. بنابراین اختلاف انرژیهای پیوندی تجربی  و محاسبه شده
و محاسبه شده  که انرژی رزونانس یونی نامیده میشود را میتوان معیاری از اختلاف الکترونگاتیوی دو اتم
که انرژی رزونانس یونی نامیده میشود را میتوان معیاری از اختلاف الکترونگاتیوی دو اتم 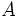 و
و  در نظر گرفت (معادله زیر):
در نظر گرفت (معادله زیر):
پائولینگ جذر این اختلاف را برحسب الکترون ولت به عنوان اختلاف الکترونگاتیوی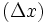 معرفی نمود اگر
معرفی نمود اگر  برحسب
برحسب  باشد داریم:
باشد داریم:
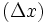 معرفی نمود اگر
معرفی نمود اگر  برحسب
برحسب  باشد داریم:
باشد داریم: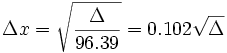
توجه کنید که،
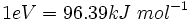
بنابراین برای مثال فوق خواهیم داشت:
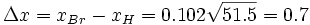
از این روش همیشه اختلاف الکترونگاتیوی دو اتم به دست میآید. برای به دست آوردن مقدار 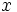 برای هر اتم، پائولینگ به طور دلخواه الکترونگاتیوی فلوئور را به عنوان الکترونگاتیوترین عنصر، 4 در نظر گرفت. بنابراین چون از روش بالا
برای هر اتم، پائولینگ به طور دلخواه الکترونگاتیوی فلوئور را به عنوان الکترونگاتیوترین عنصر، 4 در نظر گرفت. بنابراین چون از روش بالا  به دست میآید، نتیجه میگیریم که
به دست میآید، نتیجه میگیریم که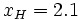 است. با قرار دادن
است. با قرار دادن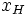 در معادله بالا، الکترونگاتیوی برم در مقیاس پائولینگ 2.8 به دست میآید.
در معادله بالا، الکترونگاتیوی برم در مقیاس پائولینگ 2.8 به دست میآید.
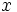 برای هر اتم، پائولینگ به طور دلخواه الکترونگاتیوی فلوئور را به عنوان الکترونگاتیوترین عنصر، 4 در نظر گرفت. بنابراین چون از روش بالا
برای هر اتم، پائولینگ به طور دلخواه الکترونگاتیوی فلوئور را به عنوان الکترونگاتیوترین عنصر، 4 در نظر گرفت. بنابراین چون از روش بالا  به دست میآید، نتیجه میگیریم که
به دست میآید، نتیجه میگیریم که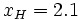 است. با قرار دادن
است. با قرار دادن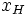 در معادله بالا، الکترونگاتیوی برم در مقیاس پائولینگ 2.8 به دست میآید.
در معادله بالا، الکترونگاتیوی برم در مقیاس پائولینگ 2.8 به دست میآید.جدول زیر الکترونگاتیوی عناصر را برحسب مقیاس پاولینگ نشان میدهد.
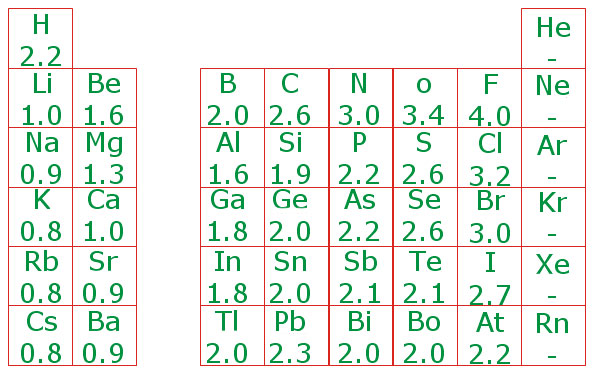
مثال
انرژی پیوندهای ساده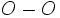 و
و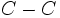 به ترتیب
به ترتیب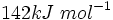 و
و 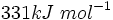 میباشد. با توجه به اینکه الکترونگاتیوی اکسیژن و کربن در مقیاس پائولینگ به ترتیب 5/3 و 5/2 میباشد انرژی پیوندی
میباشد. با توجه به اینکه الکترونگاتیوی اکسیژن و کربن در مقیاس پائولینگ به ترتیب 5/3 و 5/2 میباشد انرژی پیوندی  را به دست آورید.
را به دست آورید. حل
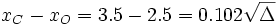
بنابراین:
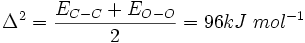
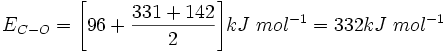
مقادیر الکترونگاتیوی پاولینگ با بسیاری از نتایج تجربی سازگاری داشت و براساس آن بسیاری از پدیدهها قابل توجیه بود. از این رو، مورد پذیرش همگان قرار گرفت. حتی با اینکه بعدها چندین روش برای تعیین الکترونگاتیوی عناصر ارائه شده بود، مقیاس پاولینگ برای الکترونگاتیوی، به عنوان یک مقیاس پایه برای الکترونگاتیوی تلقی و مقادیر به دست آمده از روشهای دیگر با این مقیاس پایه، مقایسه و معمولاً به آن تبدیل میشوند.
از آنجایی که مفهوم الکترونگاتیوی اتم، مفهومی نسبی است و آن را به طور دقیق نمیتوان توصیف و مشخص کرد، از اینرو، در منابع مختلف، در زمینه الکترونگاتیوی، با برداشتهای متفاوتی از این مفهوم و نیز روشهای گوناگون برای تعیین مقدار و مقیاسهای مختلفی برای آن، برخورد میکنیم. البته نتایج حاصل از این روشهای متفاوت، با یکدیگر سازگاری داشته و همه باید با به کار بردن ضرایب معینی به سادگی قابل تبدیل به مقیاس پاولینگ باشند و با آن هماهنگی داشته باشند.