شیمی کوانتوم
شیمی کوانتوم
دید کلی
شیمی کوانتومی ، دانش کاربرد مکانیک کوانتومی در مسایل مربوط به شیمی است. اثر شیمی کوانتومی ، در شاخههای وابسته به شیمی قابل لمس است. مثلا :
- علمای شیمی فیزیک ، مکانیک کوانتومی را (به کمک مکانیک آماری) در محاسبات مربوط به خواص ترمودینامیکی (مانند آنتروپی و ظرفیت حرارتی) گازها ، در تفسیر طیفهای مولکولی به منظور تائید تجربه خواص مولکولی (مانند طولها و زوایای پیوندی) ، در محاسبات نظری خواص مولکولی ، برای محاسبه خواص حالات گذار واکنشهای شیمیایی به منظور برآورد ثابتهای سرعت واکنش ، برای فهم نیروهای بین مولکولی و بالاخره برای بررسی ماهیت پیوند در جامدات بکار میبرند.
- علمای شیمی آلی از مکانیک کوانتومی ، برای برآورد پایداریهای نسبی مولکولها ، محاسبه خواص واسطههای واکنش ، بررسی ساز و کار واکنشهای شیمیایی ، پیش بینی میزان ترکیبات و تحلیل طیفهای NMR استفاده میکنند.
- علمای شیمی تجزیه از مکانیک کوانتومی برای تفسیر شدت و فرکانسهای خطوط طیفی استفاده میکنند.
- علمای شیمی معدنی از نظریه میدان لیگاند که یک روش تقریبی مکانیک کوانتومی است، در توضیح خواص یونهای مرکب فلزات واسطه سود میبرند.
فرضیه پلانک ، سرآغاز مکانیک کوانتومی
در سال 1900، "ماکس پلانک" ، نظریهای ابداع کرد که با منحنیهای تجربی تابش جسم سیاه ، مطابقتی عالی از خود ارائه داد. فرض او این بود که اتمهای جسم سیاه ( مادهای که تمام نورهای تابیده به آن را جذب کند ) ، تنها قادرند نورهایی را گسیل سازند که مقادیر انرژی آنها توسط رابطه hv داده میشود. در رابطه ، v فرکانس تابش و h ، ثابت تناسب است که به ثابت پلانک معروف است. با قبول مقدار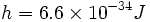 ، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.
، منحنیهایی بدست میآیند که با منحنیهای تجربی جسم سیاه کاملا مطابقت دارند. کار پلانک سرآغاز مکانیک کوانتومی بود.به دنبال پلانک ، "انیشتین" نیز مشاهدات مزبور را بر اساس اندیشه تشکیل نور از اجزایی ذره گونه تشریح کرد که آنها را فوتون نامید که انرژی هر یک از آنها برابر است با:

احتمال و مکانیک کوانتومی
موضوع احتمال ، یک نقش اساسی را در مکانیک کوانتومی ایفا میکند. در مکانیک کوانتومی ، سروکار ما با احتمالاتی است که با متغیر پیوستهای مانند مختصه x درگیرند. صحبت از احتمال پیدا شدن یک ذره در یک نقطه خاص مانند x = 0.5000 حاوی چندان معنایی نیست، زیرا تعداد نقطهها در روی محور x نامتناهی ، ولی تعداد در اندازه گیریهای ما به هر حال متناهی است و از این رو ، احتمال وصول با دقت به 0.5000 بینهایت کم خواهد بود.این است که به جای آن از احتمال یافتن ذره در یک فاصله کوتاه از محور x ، واقع بین x+dx , x صحبت میشود که در آن dx یک طول بینهایت کوچک است. طبیعتا احتمال فوق متناسب با فاصله کوچک dx بوده و و برای نواحی مختلف محور x متغیر خواهد بود. بنابراین احتمال اینکه ذره در فاصله مابین x و x+dx پیدا شود، مساوی g(x)dx است که در اینجا (g(x بیانگر نحوه تغییرات احتمال روی محور x است. تابع (g(x چون برابر مقدار احتمال در واحد طول است، لذا چگالی احتمال نامیده میشود.
چون احتمالات ، اعداد حقیقی و غیر منفیاند، لذا (g(x باید یک تابع حقیقی باشد که همه جا غیر منفی است. تابع موج
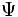 میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل میپذیرد که چگالی احتمال برابر
میتواند هر مقدار منفی و یا مقادیر مختلط را به خود بگیرد و از این نظر به عنوان یک چگالی احتمال محسوب نمیشود. مکانیک کوانتومی به عنوان یک اصل میپذیرد که چگالی احتمال برابر 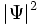 است.
است. اصل عدم قطعیت هایزنبرگ
اندیشه "بوهر" مبنی بر اینکه هر الکترون در اتم ، تنها میتواند کمیتهای معین انرژی را دارا باشد، گام مهمی در رشد و تکوین نظریه اتمی بود (مدل اتمی بوهر). نظریه بوهر برای توجیه طیف اتم هیدروژن ، مدلی رضایت بخش ارائه کرد، اما تلاش برای بسط نظریه به منظور تشریح طیف اتمهای دارای بیش از یک الکترون ناموفق بود. دلیل این مشکل به زودی آشکار شد.در نگرش بوهر ، الکترون به عنوان ذرهای باردار متحرک ، در نظر گرفته میشود. برای پیش بینی دقیق مسیر یک جسم متحرک ، دانستن مکان و سرعت جسم در هر لحظه معین ضروری است. اصل عدم قطعیت هایزنبرگ (1926) نشان میدهد که تعیین دقیق مکان و اندازه حرکت جسمی به کوچکی الکترون ناممکن است. هرچه تلاش کنیم که یکی از این کمیتها را دقیقتر تعیین کنیم، از دقت کمیت دیگر ، نامطمئنتر هستیم.
مشاهده اشیا با دریافت انعکاس پرتوهای نوری که برای روشن کردن آنها بکار رفته است، امکانپذیر است. برای تعیین موقعیت جسمی به کوچکی یک الکترون ، تابشی با طول موج به غایت کوتاه مورد نیاز است. چنین تابشی ، طبعا فرکانس بسیار بالایی خواهد داشت و بسیار پرانرژی خواهد بود. وقتی این تابش به الکترون برخورد کند، سبب تغییر تندی و جهت حرکت آن میشود. از این رو هر گونه تلاش برای تعیین موقعیت الکترون ، اندازه حرکت آن را به شدت تغییر میدهد. فوتونهایی که طول موج بلندتر دارند، کم انرژیترند و تاثیر کمتری بر اندازه حرکت الکترون میگذارند، ولی به علت بلندی طول موجشان ، نخواهند توانست موقعیت دقیق الکترون را نشان دهند.
از این رو ، این دو نوع عدم قطعیت با هم مرتبطند. به گفته هایزنبرگ ، حاصلضرب عدم قطعیت در مورد یک شیء ،
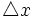 و عدم قطعیت در اندازه حرکت آن ،
و عدم قطعیت در اندازه حرکت آن ، 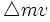 ، برابر یا بزرگتر از حاصل بخش ثابت پلانک ، h و 4? است:
، برابر یا بزرگتر از حاصل بخش ثابت پلانک ، h و 4? است:
عدم قطعیت در اندازه گیری ، برای اشیایی به کوچکی الکترون بسیار مهم است، در حالی که برای اشیا با اندازه معمولی بیاهمیت است.
معادله شرودینگر
اصل عدم قطبیت هایزنبرگ نشان میدهد که هر نوع کوشش در راه جامعتر و دقیق کردن مدل بوهر ، بینتیجه است، زیرا تعیین دقیق مسیر الکترون در یک اتم ناممکن است. از سوی دیگر ، "شرودینگر" ، رابطه دوبروی را برای تدوین معادلهای بکار برد که الکترون را برحسب خصلت موجی آن توصیف میکند.معادله شرودینگر پایه مکانیک موجی است. معادله برحسب یک تابع موجی
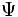 برای الکترون نوشته میشود. وقتی معادله برای الکترون در اتم هیدروژن حل میشود، یک سلسله تابع موجی بدست میآید. هر تابع موجی به یک حالت معین انرژی برای الکترون مربوط است و ناحیهای در اطراف هسته را توضیح میدهد که در آن ، امکان یافتن الکترون وجود دارد. تابع موجی یک الکترون آنچه را که یک اوربیتال نامیده میشود، توضیح میدهد.
برای الکترون نوشته میشود. وقتی معادله برای الکترون در اتم هیدروژن حل میشود، یک سلسله تابع موجی بدست میآید. هر تابع موجی به یک حالت معین انرژی برای الکترون مربوط است و ناحیهای در اطراف هسته را توضیح میدهد که در آن ، امکان یافتن الکترون وجود دارد. تابع موجی یک الکترون آنچه را که یک اوربیتال نامیده میشود، توضیح میدهد.شدت هر موج ، با مجذور دامنه آن متناسب است. تابع موجی ،
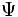 ، تابع دامنه است. مقدار
، تابع دامنه است. مقدار 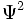 برای یک حجم کوچک در هر موقعیتی در فضا ، متناسب با چگالی بار الکترونی در آن حجم است.
برای یک حجم کوچک در هر موقعیتی در فضا ، متناسب با چگالی بار الکترونی در آن حجم است.میتوان تصور کرد که بار الکترون به سبب حرکت سریع الکترون به صورت ابر باردار در فضای دور هسته گسترده شده است. این ابر در برخی نواحی غلیظتر از نواحی دیگر است. احتمال یافتن الکترون در هر ناحیه معین متناسب با چگالی ابر الکترونی در آن ناحیه است. این احتمال در ناحیهای که ابر الکترونی غلیظتر است، بیشتر خواهد بود. این تفسیر کوششی برای توصیف مسیر الکترون ، به عمل نمیآورند، بلکه فقط پیش بینی میکند که احتمال یافتن الکترون در کجا بیشتر است.
